路上遍布荆棘了,但一定有人披荆斩棘
近日,全球规模最大、最具权威的医学盛会之一 —— 2022年美国癌症研究协会(AACR)年会在新奥尔良举行,大会汇集了全球各大制药巨头、新兴生物技术企业,分享抗肿瘤领域最新研究成果。
中国创新生物药企亘喜生物公布了基于其TruUCAR平台开发的高度差异化的候选产品:CD19/CD7双靶向CAR-T疗法GC502,针对复发/难治性急性B淋巴细胞白血病(r/r B-ALL)的首次人体试验(FIH)数据,初步临床数据显示出卓越的安全性和有效性。
区别于目前已获批的CAR-T产品,GC502是一款通用型同种异体CAR-T疗法,意味着CAR-T或能逐步实现规模化生产,大大提高可及性和用药便利性的同时,对于病程进展迅速的患者,也能带来积极的临床获益。此外,其差异化设计能使其在特异性杀伤肿瘤的同时,更有效地避免同种异体细胞疗法天然存在的排异反应。
| 亘喜生物此次公布的是GC502截至2022年1月28日的FIH研究数据。
结果显示: 4名入组的r/r B-ALL患者,接受了两种不同剂量水平和两种不同配方的治疗。值得一提的是,所有患者此前均接受过深度的既往治疗,包括都曾接受了自体或供者来源的靶向CD19或靶向CD19/CD22的CAR-T细胞治疗。 • 4名患者中有3名患者达到了微小残留病灶阴性的完全缓解/血细胞数量未完全恢复的完全缓解(MRD-CR/CRi); • 1名患者在1个月时达到了部分缓解,随后在第39天接受了同种异体造血干细胞移植; 在安全性方面: 治疗过程中,患者对TruUCAR GC502的单次输注总体耐受良好,出现了2级/3级的细胞因子释放综合征(CRS),尤其是接受配方B的两位患者均只有2级CRS;无患者出现4级/5级的CRS;同时,未观察到免疫效应细胞相关神经毒性综合征(ICANS)或急性移植物抗宿主病(aGvHD),所有不良反应都可控、可逆。 |
CAR-T让血液肿瘤不再是绝症,成为可被治愈或长期可控的慢性疾病。
从2017年全球第一款CAR-T产品获得FDA批准上市,到2022年3月为止,全球已获批8款CAR-T产品(其中3款来自中国企业)。
在全球共同努力下,我们朝着攻克癌症的目标前行。
01
十年后,CAR-T疗法下一个“里程碑”在哪?
一百多年前,美国纽约外科医生William Coley在一次手术中,发现一位肿瘤患者感染链球后,其肿瘤病灶越来越小。他意识到,也许感染唤醒了患者的免疫防御,或为治疗肿瘤提供了新方法。
于是在不断实验中,他组合各种细菌并命名为Coley毒素,以此成功治疗了几百例肿瘤患者。自此,肿瘤免疫疗法为制药领域打开一个全新的世界,并成为引领各大药企现阶段甚至下一个十年的研发趋势。
肿瘤免疫疗法包括:小分子免疫调节药物、大分子生物抗体治疗(如PD-(L)1)、肿瘤疫苗、细胞和基因治疗(CAR-T等)等多种形式。
2012年,7岁的白血病患者艾米莉被完全治愈。CAR-T疗法正式引起全球轰动并成为肿瘤免疫疗法里的“明日之星”。
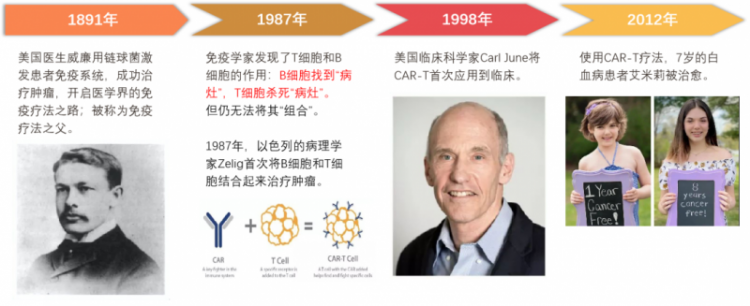
2021年,中国首次批准CAR-T产品上市;2021年8月26日,中国首例CAR-T治疗的淋巴瘤患者在上海瑞金医院出院,体内癌细胞完全清零,让众多中国癌症患者看到希望。
然而CAR-T疗法虽然效果惊人但同时也非常“小众”。因为目前已获批的以及大多数临床阶段的CAR-T疗法都是自体CAR-T(autologous CAR-T)。

截止2022年3月全球获批CAR-T产品
CAR-T与以往的抗癌药不同,它是一种“活体药物”;整个生产过程包括几十个步骤,因此生产成本很高。
自体CAR-T作为一种个体化精准治疗技术,需要患者自身T细胞在体外转导-扩增-回输,可谓“专属定制”;因此也产生了一定的局限:
- 患者在抽取T细胞后需要等待数周时间,此后部分患者或因不能产生合格的T细胞导致治疗无法进行;
- 婴幼儿及重症患者,或因无法获得足够的有效T细胞,而不能进行有效治疗;
- “私人定制”一个患者一个批次,也直接导致了巨额的治疗成本。
因此,科学家们也在不断探索,是否可以设计制造出和常规“药品”一样简便的通用型CAR-T?
2015年,一家名为Cellectis的公司首次使用通用型CAR-T技术在试验中成功救治了英国一位患有急性淋巴细胞白血病的1岁女婴Layla,通用型CAR-T疗法开始引发社会关注。
2015年后,CAR-T也真正进入临床研究爆发期。截至2022年3月,全球已有超1098项CAR-T临床试验进行中(超过95%处于临床II期及更早阶段),中国以超过557项位居全球首位。其中近50%集中在单靶向CD19,同质化程度已超越PD-(L)1;而通用型CAR-T临床试验在所有CAR-T里占比更是不到5%。
通用型CAR-T(UCAR-T),使用同种异体来源的T细胞制备而成,又被称为“现货型”(off-the-shelf)。因为是对来自健康捐赠者的T细胞进行改造,且无需HLA配型;使其生产成本更低、可规模化生产,对于患者可随时、灵活给药,使用、分发及存储方式与抗体类药物类似。
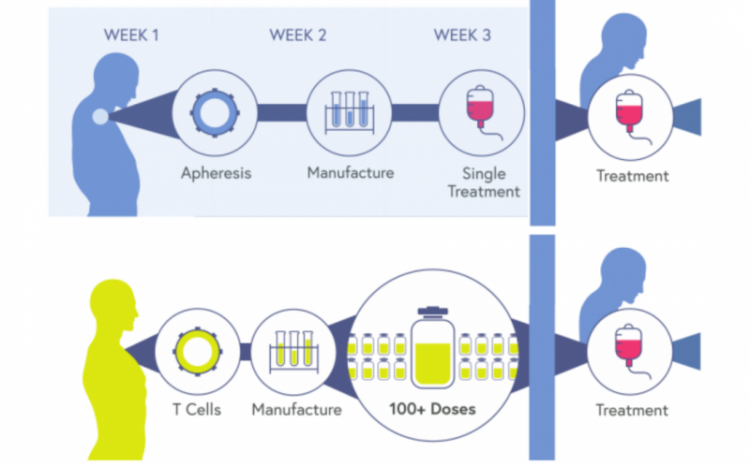
自体CAR-T(上)对比通用型CAR-T
然而,由于技术难度非常大,让大多数企业“望而却步”。
2017年全球首款CAR-T产品上市后,CAR-T商业化进程开始加速;据Coherent Market Insights预测,2018-2028年,全球CAR-T治疗市场规模平均年复合增长率高达46.1%。
一面是双位数高增长的市场需求,另一面是高度同质化的内卷竞争;CAR-T疗法蛋糕很大,但不是人人都有机会,而这或许是中国抗癌药水平与国际最为接近的一次。
2022年2月底,中国首款自研CAR-T产品获得FDA批准。能在高度“内卷”的CAR-T领域获得FDA认可,除了临床数据卓越,很大程度上也归因于提前布局彼时还未得到有效验证的BCMA靶点赛道。
全球已获批的8款CAR-T产品,只有1款与其同靶点、同适应症。
2022年,距离首个CAR-T疗法治愈艾米莉恰好十周年。为了治愈更多癌症患者,科学家们从未停止脚步。以临床价值为导向,部分企业正在主攻通用型CAR-T领域,形成全新的差异化优势,是否会诞生CAR-T疗法下一个“里程碑”?
02
怎样的“搭积木”设计,能灵活改变“固有”缺陷?
2017年,全球首个获批临床的通用型CAR-T在试验中发生严重安全事故被FDA叫停。通用型CAR-T的安全问题再一次成为全球焦点,无疑为投身这个领域的企业进一步敲响警钟。
大健康领域从来不缺“失败”,正是不断在“失败”中涅槃成就了人类一次次超越“生命的极限”。
2017年,中国发改委发布“十三五”生物产业发展规划,要求培育符合国际规范的基因治疗、细胞治疗和免疫治疗等专业化服务平台,加快发展细胞治疗和免疫治疗等多个热门领域。
此后中国又发布一系列政策扶持,吸引了拥有技术专利的中国企业和明星资本纷纷涌入CAR-T赛道,也涌现出一批有实力与外资企业同台竞争的中国本土创新CAR-T企业,尤其在技术壁垒更高的通用型CAR-T领域,亘喜生物就是其中代表。
相较于自体CAR-T疗法,通用型CAR-T的难关主要集中在宿主与药物相互间的排异性。
如何解决移植物抗宿主病(GvHD)以及宿主抗移植物排斥反应(HvG)是异体疗法长久以来的主要挑战。
截止目前,通用型CAR-T头部梯队:
- 全球包括:Cellectis、Celyad、Allogene、Precision、CRISPR Therapeutics;
- 中国包括:亘喜生物、传奇生物、北恒生物、邦耀生物等;
而亘喜生物在本届AACR年会上展现出亮眼临床数据,或是因为其对于解决排异性有着独特的差异化设计。
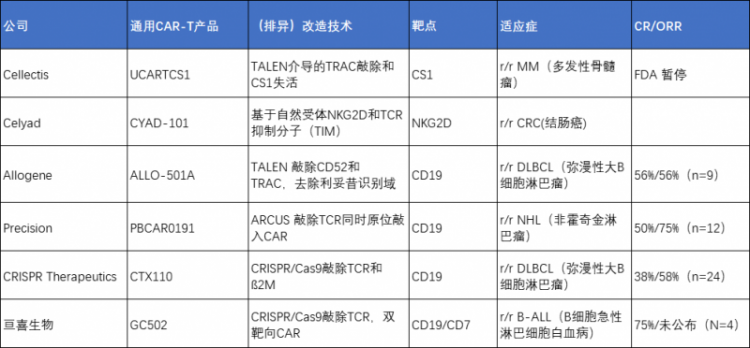
头部通用型CAR-T企业“排异改造技术”比较
对于GvHD,目前头部企业大部分利用CRISPR/Cas技术敲除T细胞中的内源性T细胞受体(TCR),防止CAR-T攻击宿主。
比起早期运用的ZFN和TALEN技术,CRISPR/Cas技术有简单、高效、易于编程等优势,并可通过添加多个向导RNA实现多重编辑。
对于HvG,目前大多数企业也通过敲除其它可能引发宿主免疫排斥的蛋白,防止被宿主细胞清除;然而对于敲除后的影响尚存不确定性。
因此,亘喜生物则采用自研的创新型双靶向CAR结构来减少宿主抗移植物排斥反应(HvG)。
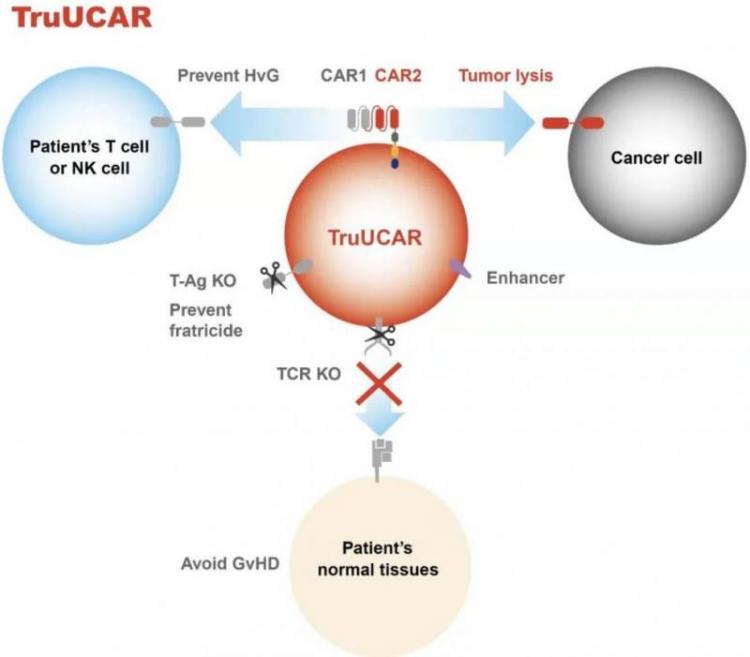
亘喜生物双靶向CAR结构设计
以CD19/CD7双靶向通用型CAR-T产品GC502为例:
- CD7 CAR用于抑制宿主抗移植物排斥反应(HvG);CD19 CAR则特异性靶向恶性肿瘤细胞。
- TruUCAR平台的设计思路是以CD7 CAR来应对HvG挑战,通过切换靶向不同肿瘤抗原的另一个CAR的结构,设计出针对各种肿瘤适应症的通用型CAR-T产品。
以上独特的设计,使患者在清淋后,无需为了防止HvG而使用额外的免疫抑制性疗法(如:抗CD52单抗),避免了患者感染的风险,也进一步降低了治疗成本。
而对于敲除内源性TCR后,可能对CAR-T细胞在体内的持久性带来影响;亘喜生物将一个增强型分子嵌入到TruUCAR的基础结构中,让TruUCAR-T细胞在进入体内后快速扩增,延长了在体内的持久性。
基于以上差异化设计,亘喜生物研发的两款通用型CAR-T不仅在CRS等安全性指数上低于大多数企业(尤其是接受GC502配方B的两位患者均只有2级CRS),还表现出不输自体CAR-T的优异疗效(GC502:75%(3/4) MRD-CR/CRi;GC027:83%(5/6) MRD-CR/CRi)。
03
当我们讨论制药企业的源头创新时,我们是在说什么?
2017年5月,在生命科学及细胞和基因治疗领域深耕三十多年的曹卫博士,成立了亘喜生物,聚焦CAR-T疗法。
数据显示,亘喜生物在CAR-T领域专利55件(排名中国第五)。包括多项通用型CAR-T疗法专利。纵观全球,中国在CAR-T领域的专利数量仅次于美国,排全球第二;这也让全球明星资本看到了中国企业的巨大潜力。
- 2019年,亘喜生物完成B轮融资,投资者包括淡马锡、OrbiMed、礼来亚洲基金、苏州民投、成都妙济;
- 2020年,完成C轮融资,由Wellington Management Company、OrbiMed和Morningside Ventures领投,Vivo、淡马锡、礼来亚洲基金、苏州民投、成都妙济参投;
- 2021年,成立三年半就在纳斯达克成功上市。
都说“出海”是中国药企“逃离”内卷的必由之路,然而出海只是结果;酒香不怕巷子深,以临床需求为导向的差异化产品才是真正解决创新药领域“内卷”的方法。
亘喜生物之所以能灵活设计差异化CAR结构,源于其自主研发的通用型CAR-T技术平台TruUCAR。配合其双特异CAR技术可以设计出双靶向CAR结构。
基于TruUCAR平台,亘喜生物已有GC502(CD7/CD19)和GC027(CD7)两款通用型CAR-T产品进入IIT临床阶段。

在去年AACR期间,GC027(CD7)作为单靶向通用型CAR-T,已经披露了针对r/r T-ALL的长期积极随访数据,亘喜也计划在未来12个月内与海外及中国监管机构开展申报沟通。此次GC502(CD7/CD19)作为双靶向通用型CAR-T,其积极数据再一次验证了基于TruUCAR平台打造同种异体通用型CAR-T细胞疗法的优势,以及该平台针对不同肿瘤适应症广泛的适用性。
而作为中国首个(FIC)供者来源异基因CAR-T疗法,GC007g已进入可以支持产品申报上市的临床I/II期注册性研究,用于治疗以往接受过造血干细胞移植(HSCT)后复发的急性B淋巴细胞白血病(B-ALL)患者。
该疗法运用了人类白细胞抗原(HLA)匹配的供体T细胞,能够解决与自体CAR-T细胞疗法相关的T细胞适应性问题。
此外,亘喜生物还有三款通用型CAR-T产品在临床前阶段。

截止目前,在美国有44%的急性淋巴细胞白血病儿童患者接受了CAR-T治疗,治愈率达60.6%;46%的弥漫性大B细胞淋巴瘤成人患者接受了CAR-T治疗,治愈率超过70%。
CAR-T技术创造过奇迹也正在让更多癌症患者燃起治愈的希望,而要真正让癌症不再是绝症,还需解决三大问题:
1. 降低副作用,进一步提升安全性
2. 降低治疗费用,可规模化生产,提升可及性
3. 攻坚实体瘤
相信全球CAR-T企业都在为之而努力。
因此,除了针对通用型CAR-T的技术平台TruUCAR,亘喜生物还自主研发了针对自体CAR-T的技术平台FasTCAR(次日即可完成生产,大幅缩短患者等待时间、降低成本),以及针对实体瘤CAR-T的技术模块SMART CARTTM;这三大原创技术平台将构建起亘喜生物CAR-T管线的未来矩阵。
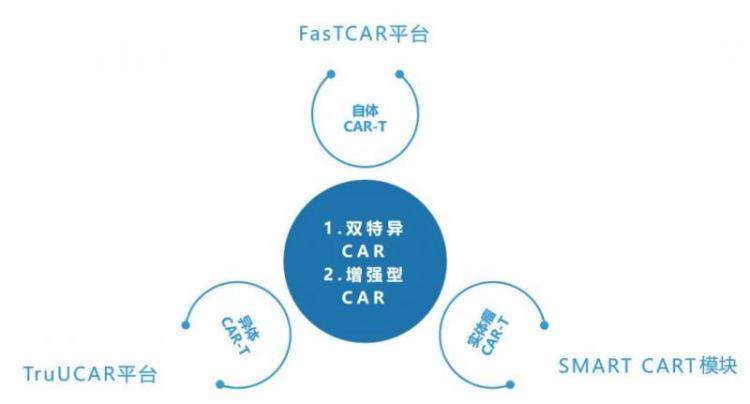
亘喜生物三大CAR-T技术平台及相应的改造技术
2022年第一季度,亘喜生物全球研发中心在加州圣迭戈市揭幕。作为其全球化战略的关键部分,该研发中心将增强和多样化其内部药物发现、临床前研究和转化能力。加上其在美国与Lonza建立cGMP流程的合作,以及在国内自主的研发及生产布局,亘喜落地创新的能力不断得以夯实。
2022,CAR-T领域首先为中国创新药企开了一个好头,相信未来将有越来越多的中国高质量创新药品亮相全球舞台。
免疫疗法开启癌症自放化疗、手术后的治疗新纪元,CAR-T疗法为癌症患者带来治愈的可能。这一定是一场长期的“马拉松”,因此除了初心、激情还需要沉下心的耐力。
真正聚焦临床痛点,静下心来、精耕细作,必然会有市场回报。亘喜生物清晰的定位和务实的创新能力,值得期待。
愿有一天,我们不再“谈癌色变”。
 透彻科技
透彻科技